 pH et équilibre acido-basique
pH et équilibre acido-basique
Effet tampon, tampons ouverts et fermés
Système tampon
Le système tampon empêche ou limite la variation de pH d'une solution lorsqu'on lui ajoute un acide ou une base forte. Il est composé de l'association d'un acide faible AH et de son anion A- ou de l'association d'une base faible BOH et de son cation B+. Si on ajoute un acide fort à la solution contenant le tampon, cet acide va se combiner sur le pôle basique du système tampon et idem pour les bases.
Exemple : le tampon bicarbonate / acide carbonique (le plus important de l'organisme)
L'acide carbonique H2CO3 est un acide faible (= pKa bas = perd difficilement ses protons H+ -> diminue peu le pH d'une solution)
Le bicarbonate de sodium NaHCO3 est un sel alcalin.
On a donc
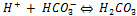
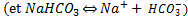
Si ce tampon réagit avec un acide fort (donc dissocié facilement en solution) notre tampon va réagir en remplaçant l'acide fort par un acide faible (l'acide carbonique), qui perdra plus difficilement ses H+ en solution, en se combinant sur le pôle basique du tampon,
Attention : Toujours raisonner en terme d'équilibre acido-basique, une réaction acido-basique est dynamique c'est a dire que si on rajoute des H+ à gauche de notre première réaction on va décaler vers la droite notre réaction afin d'essayer de maintenir l'équilibre acido-basique.
- Si on ajoute de l'acide chlorhydrique (acide fort) : HCl <=> H+ + Cl- au tampon :
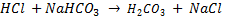
L'acide se combine sur le versant basique du tamponet notre acide fort est remplacé par un acide faible.
- Si on ajoute de la soude (base forte) :

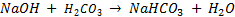
La base se combine ici sur le versant acide.
Autres exemples de tampons de l'organisme :
Couple acide acétique/ion acétate :
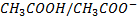
Couple ion ammonium/amoniac :
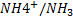
Pouvoir tampon
Le pouvoir tampon permet de déterminer l'efficacité d'un système tampon.
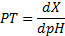
- dX : quantité de H+ versés dans la solution en mmol/L
- dpH : variation du pH de la solution
On voit donc que si on verse beaucoup d'H+ et que le pH reste constant le pouvoir tampon sera élevé, et que si le pH varie beaucoup pour un faible volume versé le pouvoir tampon sera faible.
Le PT est maximum à pH = pKa c'est à dire si le pH de la solution à tamponner est proche du pKa du système tampon.
Le PT et donc l'efficacité du système tampon est d'autant plus importante que la concentration en tampon est élevée.
Tampons ouverts et fermés
Le pH du sang artériel est remarquablement stable et constant grâce aux tampons de l'organisme : il se maintient entre 7,38 et 7,42.
- pH intracellulaire < pH extracellulaire
- pH sang veineux < pH sang artériel
- pH artériel compatible avec la vie : 6,8-7,8
Tampon ouvert
Signifie que certaines molécules de la réaction peuvent être éliminées de l'organisme.
Le tampon acide carbonique/bicarbonate est le seul tampon ouvert de l'organisme, il est extracellulaire :
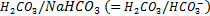
Nous avons vu l'équilibre de ce tampon :
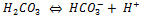
L'acide carbonique est également en équilibre avec CO2 + H20

- A un pH normal seul 1/400 du CO2 se combine en acide carbonique.
- Le pKa résultant de ce tampon est 6,1.
Le pH du sang artériel étant de 7,4, ce système tampon serait inefficace s'il était un tampon fermé.
En cas d'agression acide (augmentation des H+) la réaction est déviée vers la gauche : augmentation de l'H2CO3 (acide faible). L'augmentation de l'H2CO3 dévie encore la réaction vers la gauche afin de maintenir l'équilibre, ce qui aboutit à une augmentation de CO2.
Le dioxyde de carbone en surplus est ensuite éliminé par les poumons.
Le rein élimine également du H+ et réabsorbe des HCO3- en cas de pH trop bas. (voir diagramme de Davenport et régulation du pH)
Ce système ouvert est donc très efficace contre les agressions acides.
Il est en revanche peu efficace contre les agressions basiques puisqu'au pH normal le tampon est majoritairement sous forme basique.
Tampons fermés
Aucune molécules de la réaction n’est éliminée de l'organisme : [A-]+[AH] = constante
Plusieurs types de tampons fermés :
- Certaines protéines qui possèdent des sites tampons
- Tampons érythrocytaires : Hémoglobine
- Les phosphates en intracellulaire
Tous ces tampons sont assimilables à un seul tampon fermé de pH = 6,8.