 Les différents états de la matière
Les différents états de la matière
Propriétés colligatives : osmose, cryométrie, ébulliométrie
Osmose
L’osmose est en biophysique un phénomène de diffusion de solvant à travers une membrane semi-perméable (voir cours transport membranaire) sous l’effet d’un gradient de concentration entre les 2 compartiments. Ce gradient de concentration engendre une pression osmotique qui provoque un déplacement de solvant du milieu le moins concentré vers le milieu le plus concentré.
Pression osmotique :

On voit que le flux de solvant va du coté le moins concentré vers le coté le plus concentré sous l’effet de la pression osmotique.
La pression osmotique Π se définit comme la pression hydrostatique minimum qu’il faut exercer pour empêcher le passage d’un solvant d’une solution moins concentrée vers une solution plus concentrée au travers d’une membrane semi perméable. Une solution présente une pression osmotique dès lors qu’elle contient un soluté s pour lequel sa membrane est imperméable ou partiellement imperméable.
Si la membrane est totalement imperméable au soluté :

- Πs en Pa
- ns : nombre d’osmoles de soluté s
- R: constante des gaz parfaits (8,32 J . mol -1.°K-1 )
- T : température absolue en Kelvin
- V : volume total de la solution en m3
Si la membrane est partiellement perméable au soluté :

- σ : aire des pores imperméables au soluté / aire des pores (coefficient de réflexion du soluté sur la membrane)
La pression osmotique totale de la solution est égale à la somme du nombre de moles de chaque molécule du soluté multiplié par leur coefficient de réflexion multipliée par RT/V :

C’est la loi de Vant Hoff.
Applications de la pression osmotique :
La pression osmotique créée par les protéines s’appelle la pression oncotique.
L’osmolarité totale du plasma est d’environ 300 mOsmoles/L
Loi de Starling :
Cette loi dit que le flux entre les capillaires sanguins et le milieu interstitiel dépend de la pression résultante P telle que :
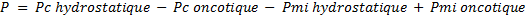
- Pc hydrostatique : Pression hydrostatique dans le capillaire
- Pc oncotique : Pression oncotique créée par les protéines plasmatiques dans le capillaire
- Pmi hydrostatique : Pression hydrostatique du milieu interstitiel
- Pmi oncotique : Pression oncotique du milieu interstitiel

Si P est positif il y a sortie de liquide du capillaire vers le milieu interstitiel, c’est le cas sur le versant artériel des capillaires.
Si P est négatif il y a entrée de liquide du milieu interstitiel vers les capillaire, c’est le cas sur le versant veineux des capillaires ou la pression hydrostatique capillaire est moindre.
Si la pression hydrostatique capillaire augmente et/ou que le taux de protéines plasmatiques il y a alors un flux plus important de liquide vers le milieu interstitiel et une rétention, c’est le mécanisme de formation des oedèmes.
Solutions hypertoniques, hypotoniques et isotoniques :
- Une solution est dite hypertonique si son osmolarité efficace est supérieur à celle du plasma (300mOsmoles/L).
- Une solution est dite hypotonique si son osmolarité efficace est inférieur à celle du plasma (300mOsmoles/L).
- Une solution est dite isotonique si son osmolarité efficace est égale à celle du plasma (300mOsmoles/L).
- Si une cellule est placée dans une solution hypertonique, elle va se déshydrater et se contracter.
- Si une cellule est placée dans une solution hypotonique, elle va gonfler jusqu'à exploser.
- Si une cellule est placée dans une solution isotonique, sa forme ne va pas varier.
Exemple de solution isotonique utilisée en pratique médicale :
NaCl 9g/L dit sérum physiologique.
Car la masse molaire du NaCl est de 60 g/mol.
On a vu qu’une mole de NaCl donne 2 osmoles.
On veut que notre solution ait une osmolarité de 300 mOsmoles/L.
m = 150.10-3 * 60 = 9 grammes de NaCl
Cryométrie
La cryométrie permet de déterminer l’osmolalité d’une solution en étudiant son delta cryoscopique c’est à dire l’abaissement de la température de fusion d’une solution par rapport à la température de fusion du solvant qui est connue.
C’est laloi de Raoult :

- ΔT : Delta cryoscopique , abaissement de la température de fusion en °C
- K : Constante cryoscopique propre au solvant en °C.kg/mol
- ω : Osmolalité de la solution en osmoles/kg
Cette loi permet d’expliquer par exemple le salage des routes l’hiver qui fait fondre la neige en abaissant la température de fusion de l’eau grâce à l’augmentation de l’osmolalité.
Ebulliométrie
L’ébulliométrie est similaire à la cryométrie mais concerne la température d’ébullition du solvant.
La présence d’un soluté augmente la température d’ébullition d’un solvant :
C’est la 2ème loi de Raoult

- ΔT : Augmentation de la température d’ébullition en °C
- K : Constante ébulliométrique propre au solvant en °C.kg/mol
- ω : Osmolalité de la solution en osmoles/kg